

全新视角:外泌体蛋白质组学
细胞外囊泡(extracellular vesicles, EVs)是细胞释放的各种具有膜结构的囊泡统称,根据囊泡的大小、合成方式、生物学性质等,EVs又会分成不同的亚型。1983年,Harding等人发现绵羊网织红细胞在成熟过程中分泌的小于50nm的小囊泡可以传递蛋白到细胞外;这类小囊泡被Johnstone于1987年命名为“Exosome”,即外泌体1;随后,1996年Raposo等发现B淋巴细胞分泌的EVs可以呈递抗原激活T淋巴细胞,参与免疫调控,我们才逐步认识到EVs的重要性。
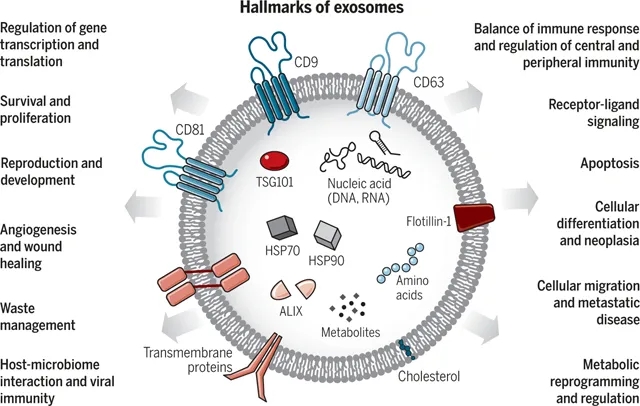
图1 细胞外囊泡的生物学、功能和生物医学应用2
随着研究的不断深入,EVs的分类不断演变,但它们通常分为两大类:微粒/微囊泡(ectosomes),外泌体(exosomes)。二者的关键性差异体现在合成方式上,微囊泡通过质膜直接向外出芽产生,其直径通常为50~1000nm。相比之下,外泌体则是先经过细胞膜内陷,在细胞内完成包装过程后再被释放到细胞外,直径通常为40~160nm。

图2 外泌体的异质性2
由于来源细胞类型不同、大小不同、包含内容物不同,导致外泌体是一群高度异质性的群体。同时,由于外泌体可以包含膜蛋白、胞质蛋白、核蛋白和细胞外基质蛋白等多种类型的蛋白质,决定了外泌体是细胞间通讯、信号转导的重要介质。越来越多的研究表明,外泌体广泛参与疾病的各种进程,以肿瘤为例,在多种癌症类型中均已报道了来自癌细胞的外泌体在转移部位引起实质信号反应,对远端微环境重塑以增强癌细胞转移,如Webber等人报道的癌细胞外泌体表面的TGFβ通过增加αSMA和FGF2的表达诱导成纤维细胞活化3。
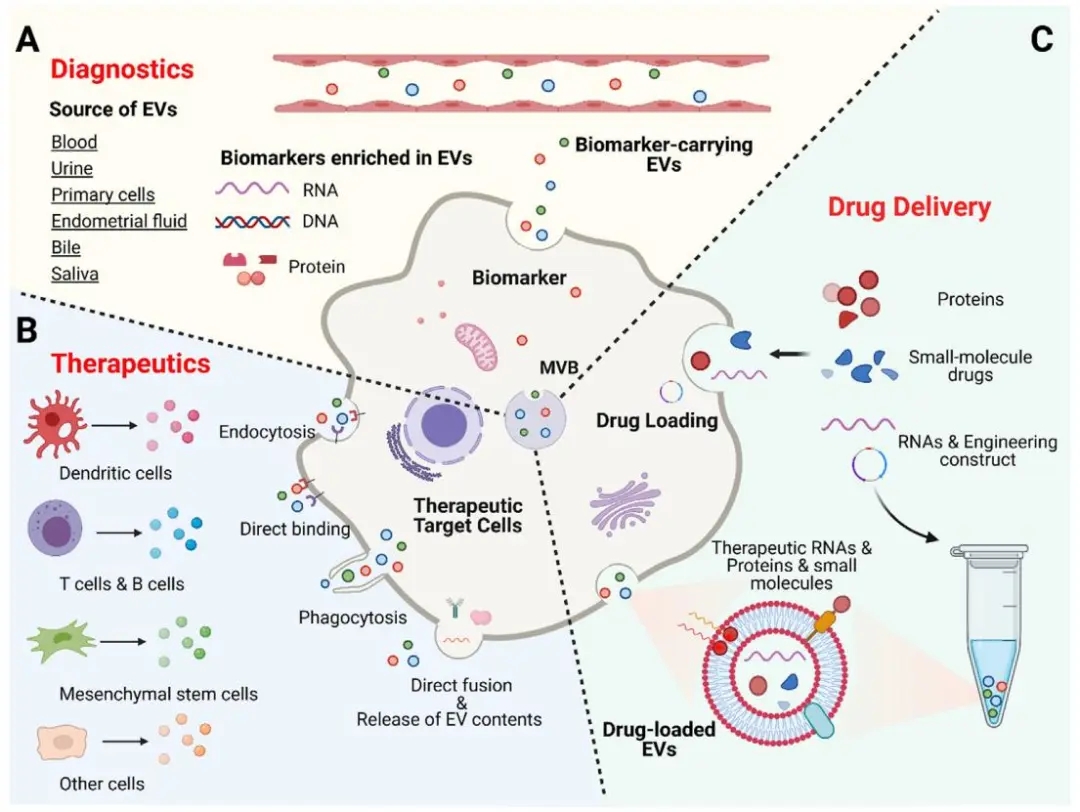
图3 外泌体的潜在应用领域4
正因为外泌体广泛的参与各种生物学进程,其在医疗领域有巨大的应用前景,主要包括疾病诊断,治疗和药物递送三个方面。随着超微量蛋白质组学的发展,更是让以外泌体来源的标志物、药物靶点发现成为了可能。尽管多项研究表明外泌体蛋白质组学在早期肿瘤检测,指导治疗策略选择的价值,但是关于外泌体蛋白质组学仍有很多未知信息,例如各个组织来源的外泌体标志物、分辨肿瘤与非肿瘤的外泌体标志物、特定癌种类型的外泌体标志物。
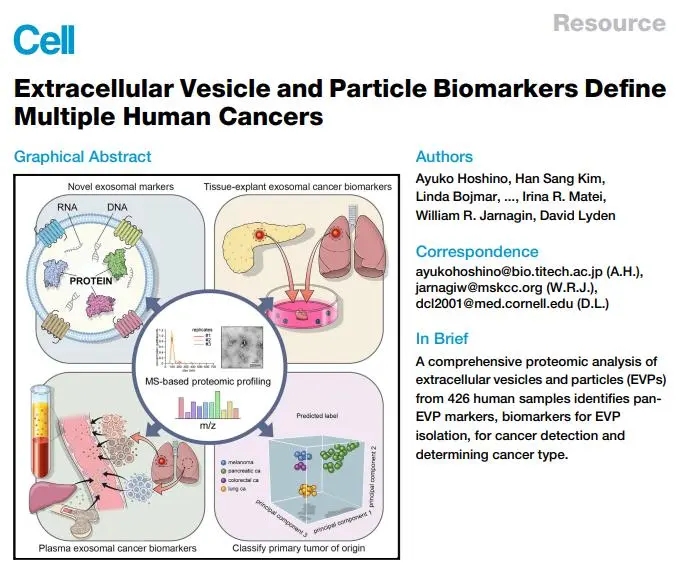
2020年,康奈尔大学研究团队在Cell (IF=66.849) 杂志发表了题为Extracellular Vesicle and Particle Biomarkers Define Multiple Human Cancers5的论文,作者对来自人源的426个外泌体样本进行了蛋白质组学分析,系统性的展示了外泌体蛋白质组学在肿瘤检测、癌症种类区分的巨大价值。文章核心内容如下:
01.不同癌种的外泌体蛋白特异性
通过对比分析胰腺癌和肺腺癌患者的癌、癌旁的外泌体蛋白质组学,作者确定了外泌体蛋白质组在不同的肿瘤类型之间存在异质性,并且能够反应对应癌症类型的生物学特征。肺腺癌的蛋白质组主要富集在细胞周期、代谢和RNA加工相关通路,而胰腺癌主要富集EMT以及肌动蛋白信号转到通路等。
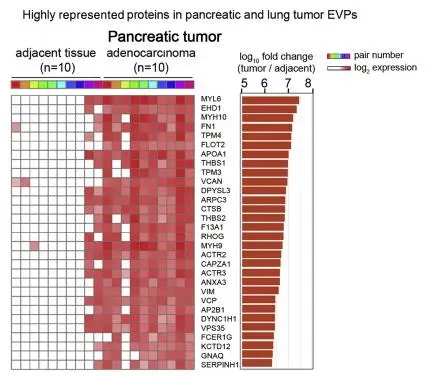
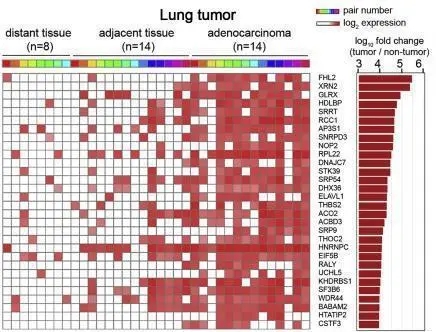
图4 胰腺癌、肺腺癌中显著差异蛋白,其中多与细胞周期、代谢和RNA加工通路相关
02.血浆外泌体蛋白组用于癌症诊断
通过对120例(分为16种癌种的77名癌症患者样本以及43名健康人样本)血浆外泌体进行蛋白质组学分析,并结合机器学习,作者鉴定出了与不同免疫球蛋白相关蛋白的组合,对癌症的检测具有高特异性的预测结果,达到95%敏感性和90%特异性,表明血浆来源的外泌体蛋白可用于液体活检以进行癌症诊断。
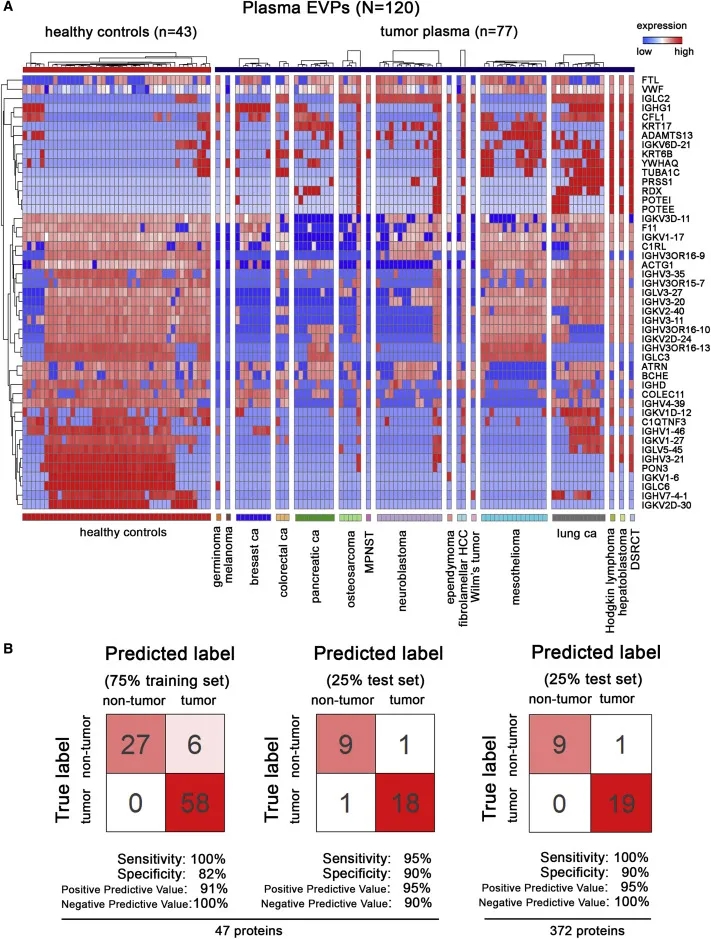
图5 多种癌种的血液外泌体蛋白组特征及机器学习分类
03.血浆外泌体蛋白可区分不同癌症类型
作者对五种不同癌症患者(乳腺癌、结直肠癌、肺癌、胰腺癌和间皮瘤)的血浆样本进行外泌体蛋白质组学分析,鉴定到30个可区分不同原发性肿瘤的外泌体蛋白,进一步对五种癌症类型外泌体分析发现,无论癌症分期如何,样本均能基于原发肿瘤类型进行聚类。更重要的是,与实体瘤来源外泌体相比,血浆外泌体能够更好区分不同癌症类型,溯源性更好。
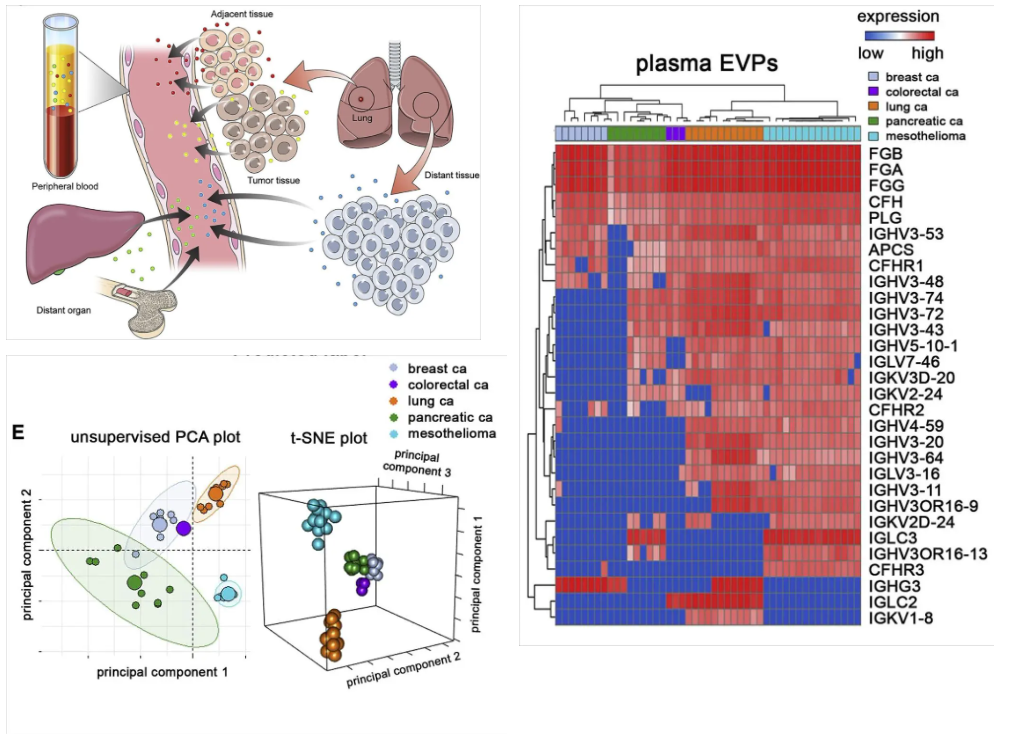
图6 基于血浆外泌体对癌症类型分类
该研究从健康、癌症患者的不同组织、血液、体液来源外泌体出发,利用蛋白质组学技术找到了适用于不同样本类型的外泌体肿瘤特异性标志物,证明了外泌体蛋白质组学用于早期癌症检测、治疗等方面的巨大价值。
贝普奥生物实测数据展示
贝普奥生物已经完成了多个外泌体样品的实测,在测试样品中,利用SISPROT针对微量样品的优势,分别对两种典型来源的外泌体样本蛋白进行了样品前处理,约5μg左右不同起始量的血浆来源外泌体样品中稳定鉴定出约4000种蛋白质,细胞来源外泌体样本中可鉴定达到6500+种蛋白质。在鉴定结果中,鉴定到了相当高比例的膜蛋白marker及外泌体marker,如CD63、CD81、ALIX、SDCBP、TSG101等均被灵敏检出且排名在前50%以内,为后续探讨细胞通讯、信号转导提供了坚实的数据基础。
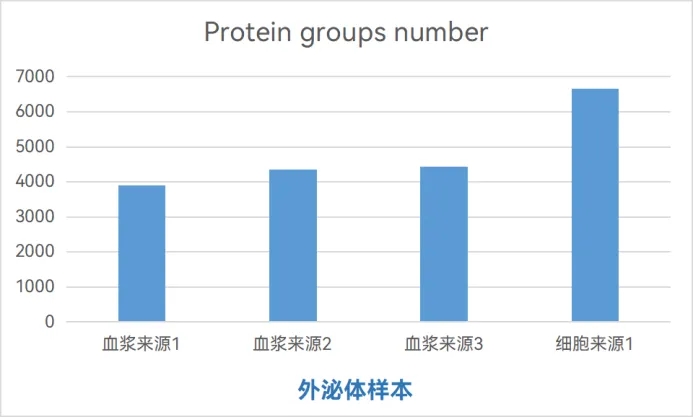
利用SISPROT技术对外泌体分析实测数据
针对如外泌体的超微量样品,贝普奥生物独家专利的SISPROT前处理试剂盒不受物种来源限制,兼容多样化样品类型、对超微量样品的高灵敏度和强稳定性,非常适合用于研究组织微环境、细胞异质性等涉及样品量稀少的研究。
贝欢迎各位老师联系贝普奥生物驻地销售或公众号私信获取更多信息!
参考文献
1、Johnstone R M et al., Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes), J Biol Chem, 262(19):9412-9420, 1987;
2、Raghu Kalluri et al., The biology, function, and biomedical applications of exosomes, Science, 367(6478), 2020;
3、Webber J et al., Cancer exosomes trigger fibroblast to myofibroblast differentiation, Cancer Res., 70, 9621–9630, 2020;
4、Pol Escudé Martinez de Castilla et al., Extracellular vesicles as a drug delivery system: A systematic review ofpreclinical studies, Adv Drug Deliv Rev. 175:113801, 2021;
5、Ayuko Hoshino et al., Extracellular Vesicle and Particle Biomarkers Define Multiple Human Cancers, Cell, 182(4):1044-1061, 2020.
深圳市贝普奥生物科技有限公司是一家于2022年1月在深圳成立的蛋白质组学研发型高科技公司。作为蛋白质组学上游市场解决方案提供商,公司致力于对蛋白质组学领域的研发成果进行商业开发及转化。团队以受多项专利保护的蛋白质组学前处理系列产品为切入点,通过临床功能蛋白质组学技术平台为目标市场提供全流程解决方案。
公司核心成员在蛋白质组学、肿瘤生物学领域获得重大科研成果,超半数员工拥有博士、硕士学位及海外研究经历。充满创造力的团队立足于大湾区,服务全球,专注于降低蛋白质组学分析技术难度,提升其在创新标志物和创新药物研发全链条中的应用,以蛋白质组学技术为重大疾病提供精准诊疗策略。
