

近日,南方科技大学田瑞军教授课题组在bioRxiv上线了题为:“Multimodal single cell-resolved spatial proteomics reveals pancreatic tumor heterogeneity”的创新性研究。该研究展示了多模态的空间细胞类型蛋白组学技术Spatial and Cell-type Proteomics(SCPro),在单细胞分辨率下揭示了胰腺癌病理切片组织的异质性。

一、文章要点概括
本文开发了用于可视化空间蛋白组学的SCPro技术。SCPro技术包含多色荧光染色FFPE切片的全景组织定量分析,多抗体荧光激活细胞分选(Fluorescence-Activated Cell Sorting, FACS), 以衍生于Simple and Integrated Spintip-Based Technology (SISPROT)技术的ion exchange-based protein aggregation capture (iPAC) 技术为纽带, 结合空间解卷积算法对胰腺癌的肿瘤微环境进行深度解析。
利用SCPro技术,在同一张4色mIHC 切片上,以全景组织定量分析结果作为导航,实现多达6种细胞类型的原位单细胞精准分离,100个组织单细胞可鉴定出>5000种蛋白质。对来自同一周龄老鼠的胰腺癌组织,在每种细胞类型细胞数量小于等于1000个的情况下,SCPro 技术建立了14种细胞类型的蛋白表达图谱。通过膜蛋白分析策略和空间解卷积算法, SCPro技术准确预测了肿瘤和淋巴结构中9种免疫细胞亚型的比例, 发现了一种新的免疫抑制T细胞亚型, 随后精准预测并验证其在胰腺癌肿瘤细胞区域而非淋巴结构区域的空间特异性。
二、本文创新点
首先,开发了基于固相萃取技术的iPAC。该技术衍生于SISPROT技术,它特别适合处理空间蛋白组学中常见的H-E染色切片,及多色荧光染色切片样本。染色组织样品经iPAC技术处理后可得到的多肽具有极高的性噪比(文中称为污染指数,contamination ratio,CR)至接近商品化Hela digest的程度。因此,使用iPAC方法处理类似数量的组织单细胞和培养的细胞样品可以达到类似的鉴定效果,在DDA 模式60min有效梯度且分别独立搜库(关闭MBR)的条件下,针对12μm厚度,0.0004mm2,0.0025mm2,0.01mm2,0.04mm2的H-E染色鼠脑组织样品 (分别相当于2.4,15,60,240个组织单细胞,以每个单细胞体积为2000μm3进行估算),可分别鉴定出超过800,2000,3200,4400种蛋白质(平均值)。
其次,该研究引入了多色荧光染色全景大视野高质量成像+组织流式导航与定量分析+组织单细胞零失败率精准分离的工作流。该工作流解决了激光微切割样本成像质量不佳, 导致无法进行mIHC切片全景准确定量分析与导航的问题,同时解决了组织单细胞分离受激光损伤大、收集失败率高且不稳定的技术痛点。实现了同一张切片原位高纯度细胞类型的深度空间蛋白组学分析。
最后,该研究引入了流式分选细胞的膜蛋白生信分析策略并提出了针对空间蛋白组学的解卷积策略。这一策略充分发挥了流式分选细胞方法表征稀有细胞亚型的优势,同时利用空间蛋白组学数据为稀有细胞亚型提供了空间定位。本研究为利用流式分选细胞类型蛋白组学数据与空间蛋白组学数据发现功能性的稀有细胞亚型及其空间定位提供了新的研究范式。例如本文通过上述策略发现了新的免疫抑制性细胞亚型Klrg1+Treg, 并将其定位在PDAC区域。
三、文章技术详解

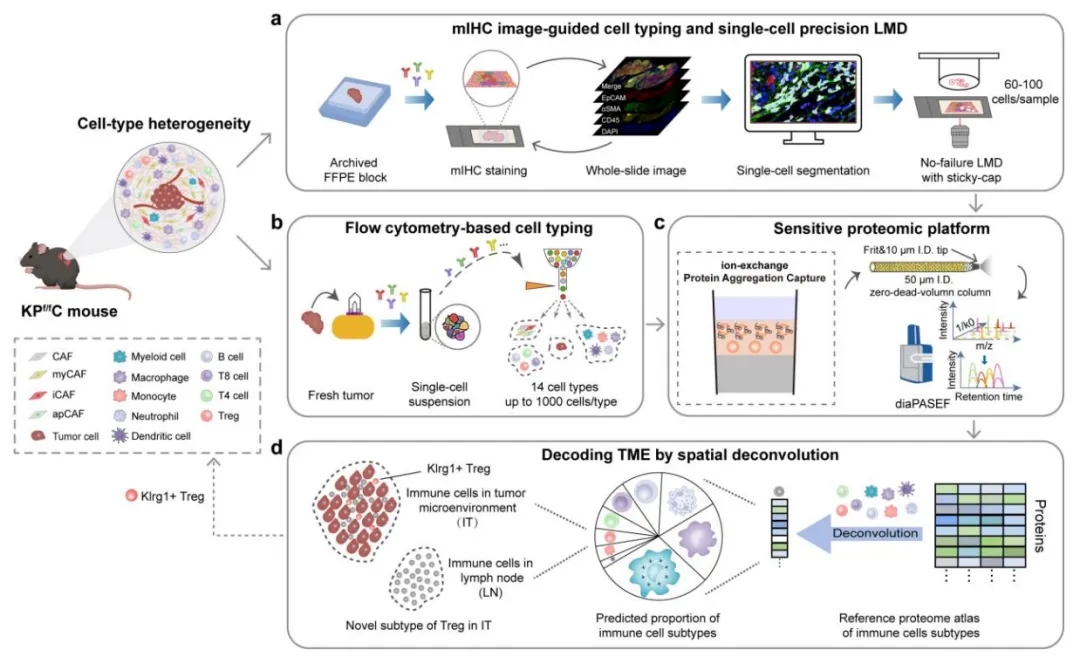
SCPro空间可视化蛋白组学技术路线
3.1 空间蛋白质组
作者在厘米级的胰腺癌组织切片中通过多重免疫荧光的方式标记了EpCAM+细胞、CD45+细胞和αSMA+细胞,共确定了胰腺癌的显微切割区域。染色结果显示在肿瘤从腺泡细胞到胰腺上皮内瘤样(PanIN)最后到PDAC的过程中,不同细胞类型细胞的空间分布有明显不同。其中技术重点为(1)厘米级大视野高质量成像与基于组织流式圈门的ROI选取;(2)基于导航ROI的单细胞精度分离与零损失样品收集及质控。
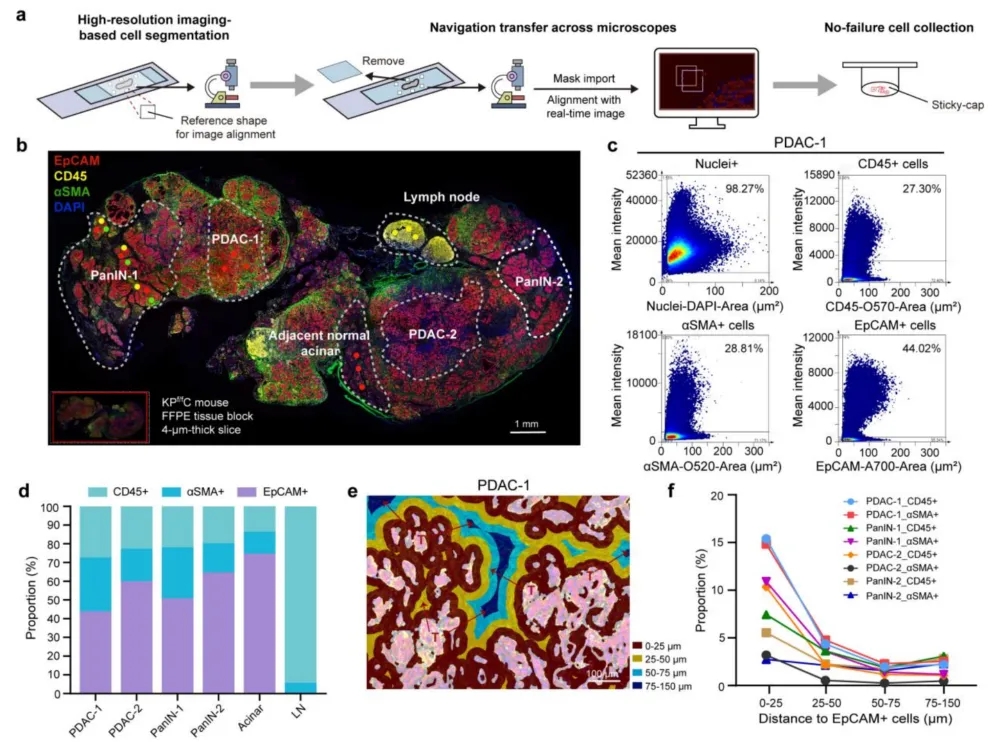
全景组织流式空间细胞类型导航与单细胞精度组织分离
3.2 细胞类型蛋白质组
为了在空间层面上获得更细致的细胞类型分布,作者在小鼠模型中,通过流式细胞术分离了14种细胞类型,包括4种CAFs,9种免疫细胞和胰腺癌细胞,每种细胞类型分选1000个细胞,并进行质谱的蛋白质组学检测,共鉴定了超过7000种蛋白质。
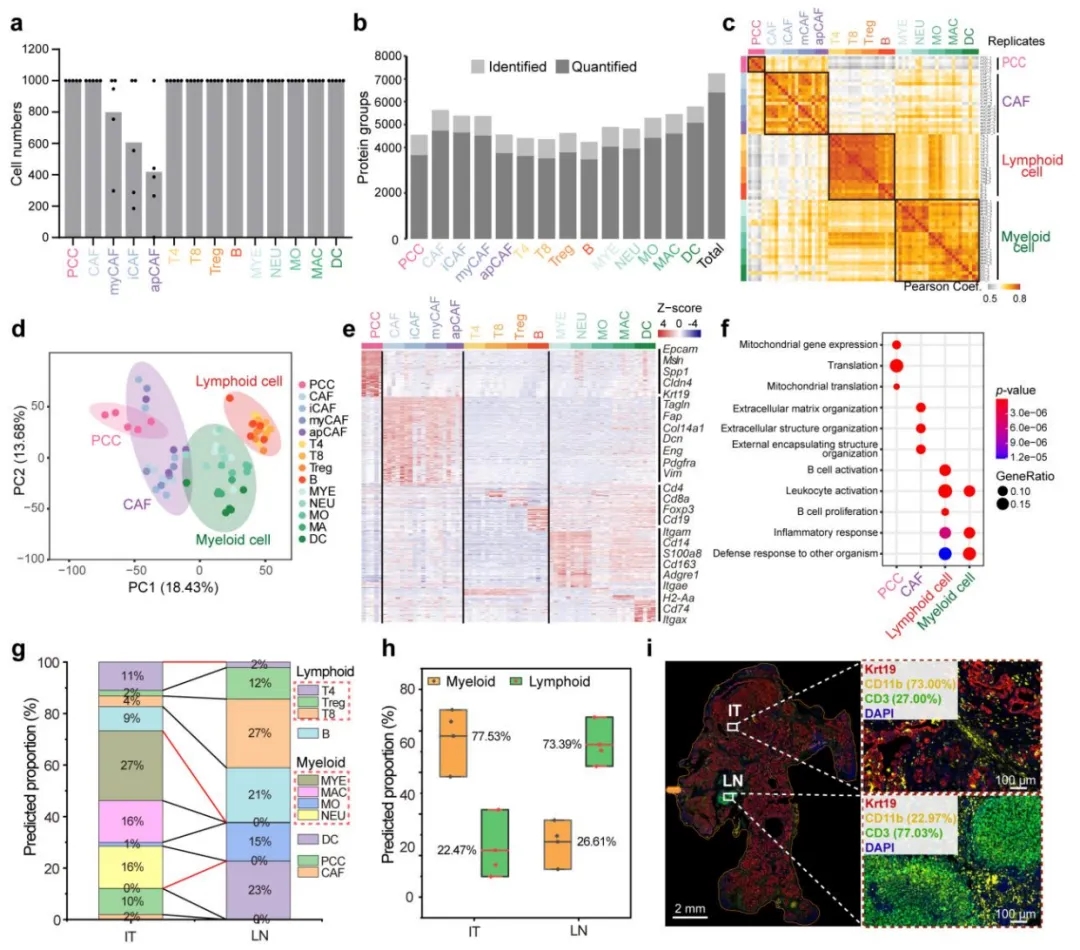
基于细胞分选的细胞类型蛋白质组
3.3 高灵敏样品处理及数据采集
基于iPAC技术的高灵敏度蛋白组学处理,色谱分离及质谱数据采集是支持空间蛋白质组和细胞类型蛋白质组获得深度蛋白质定性定量分析的根本。本研究带给我们的重要启示是,多肽的信噪比或“干净”程度与多肽的回收率同等重要,如下图所示,使用基于固相萃取的iPAC技术, 通过染色组织获得多肽的干净程度接近于商品化的Hela digest,对0.04mm2*12μm(相当于240个组织单细胞)H-E染色鼠脑切片,在质谱总信号相当的情况下,鉴定量可提高3倍以上。在DDA且关闭MBR的模式下可鉴定出超过4400种蛋白质。
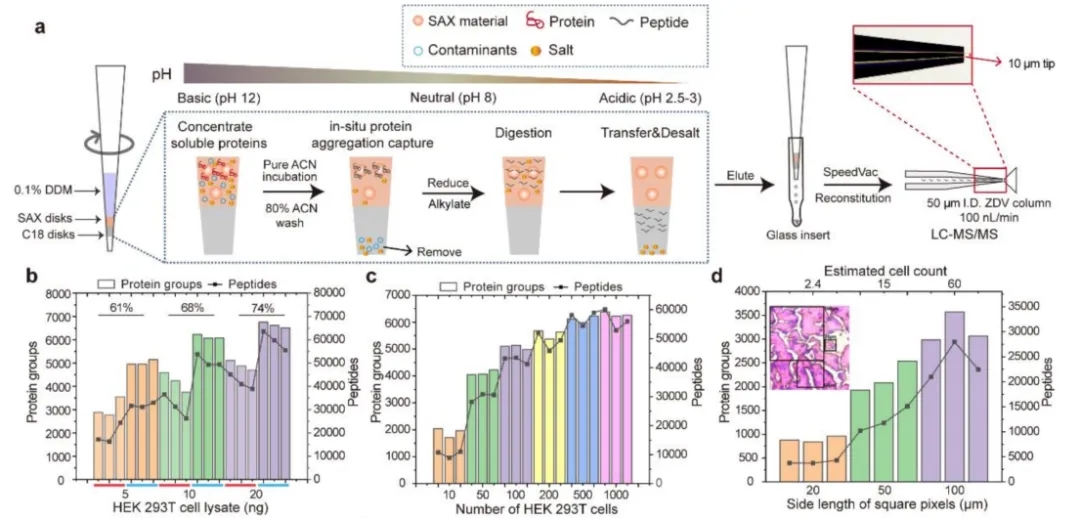
iPAC技术原理与效果
四、应用解读
4.1 SCPro技术揭示不同进展阶段胰腺癌细胞的空间蛋白质组特征
基于高质量的全景组织流式定量分析,该研究展示了胰腺癌发展不同阶段,即从正常腺泡(Acinar)到腺上皮内瘤变 (PanIN) 以及最终的胰腺导管癌 (PDAC)周围不同距离的免疫细胞, 间质的空间定量分布特征。
从60-100个FFPE组织单细胞中, SCPro技术可鉴定出3000-5000种蛋白质(通常来说3000个及以上的蛋白深度是发现功能性蛋白的门槛), 主成分分析(PCA)可以很好的区分不同发展阶段的胰腺癌肿瘤细胞。同时,已报道的生物标志物蛋白也在Acinar, PanIN以及PDAC阶段的胰腺癌细胞中显著富集。其次,各阶段的Top功能性通路与文献中已报道的相关通路相吻合。最后,SCPro技术找到了在肿瘤进展过程中, 特别是在PanIN阶段发生显著变化的功能性蛋白,这为发现潜在的胰腺癌早筛生物标志物提供了重要的参考。
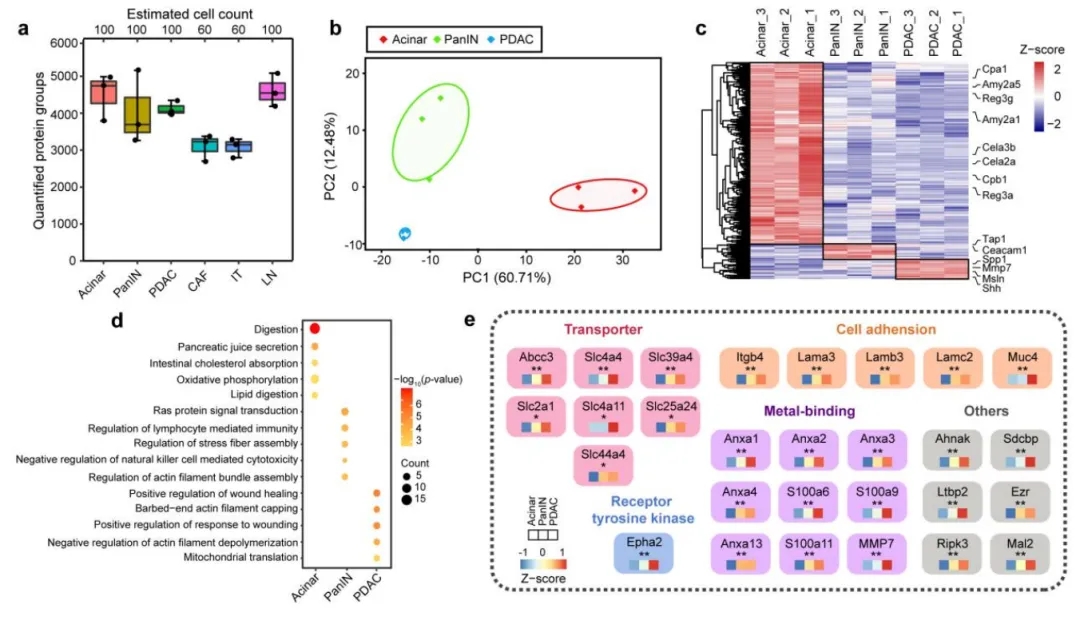
胰腺癌肿瘤进展过程中蛋白组学变化特征
4.2 SCPro技术揭示胰腺癌细胞周围及附近淋巴结构中免疫细胞的空间蛋白质组特征
作者在厘米级的胰腺癌组织切片中通过多重免疫荧光的方式标记了EpCAM+细胞、CD45+细胞和αSMA+细胞,确定了胰腺癌的显微切割区域。染色结果显示在肿瘤从腺泡细胞到胰腺上皮内瘤样(PanIN)最后到PDAC的过程中,不同细胞类型细胞的空间分布有明显不同。SCPro技术揭示了PDAC区域的免疫细胞与淋巴结构中的免疫细胞具有显著不同的蛋白组学特征。
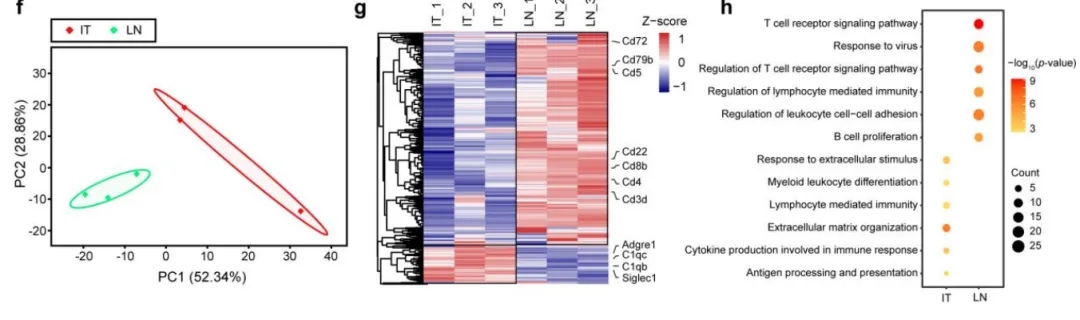
4.3 SCPro技术揭示PDAC及邻近淋巴结构中的细胞亚群分布比例
使用特色的细胞膜marker筛选策略,利用Phobius和DeepTMHMM预测跨膜蛋白,结合Tangram解卷积算法,发现了新的免疫抑制性Treg细胞亚型,为了在空间层面上获得更细致的细胞类型分布,作者在小鼠模型中,通过流式细胞术分离了14种细胞类型,包括4种CAFs,9种免疫细胞和胰腺癌细胞,每种细胞类型分选1000个细胞,并进行质谱的蛋白质组学检测,共鉴定了超过7000种蛋白质。然后,作者通过Tangram解卷积空间解卷积算法进一步解码肿瘤PDAC(IT)区域和PDAC临近淋巴结构(LN)区域中11种细胞亚群的占比,并通过多重免疫荧光染色Krt19(肿瘤细胞标志物)、CD11b(髓系细胞标志物)、CD3(淋巴细胞标志物)进行验证。空间解卷积算法预测的IT区域的髓系细胞和淋巴细胞的比例为77.53% 与 22.47%, 这与实际多色荧光染色(ground truth)的细胞比例高度一致, 分别为73% 和27%, 这证明了空间解卷积算法的准确性。
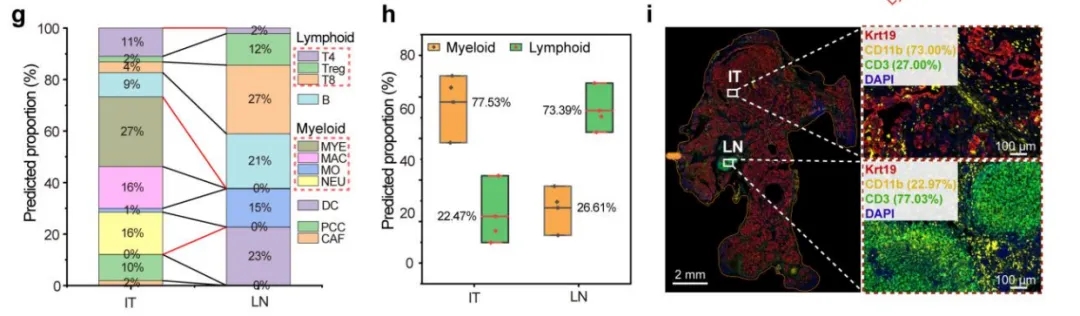
空间解卷积算法预测11种免疫细胞亚群比例
4.4 SCPro技术发现新的免疫抑制性细胞亚型并预测其定位于PDAC区域
使用特色的细胞膜marker筛选策略,利用Phobius 和 DeepTMHMM预测跨膜蛋白,发现了新的免疫抑制性Treg细胞亚型。进一步的空间解卷积算法将其定位于PDAC区域而非临近的淋巴结构区域。
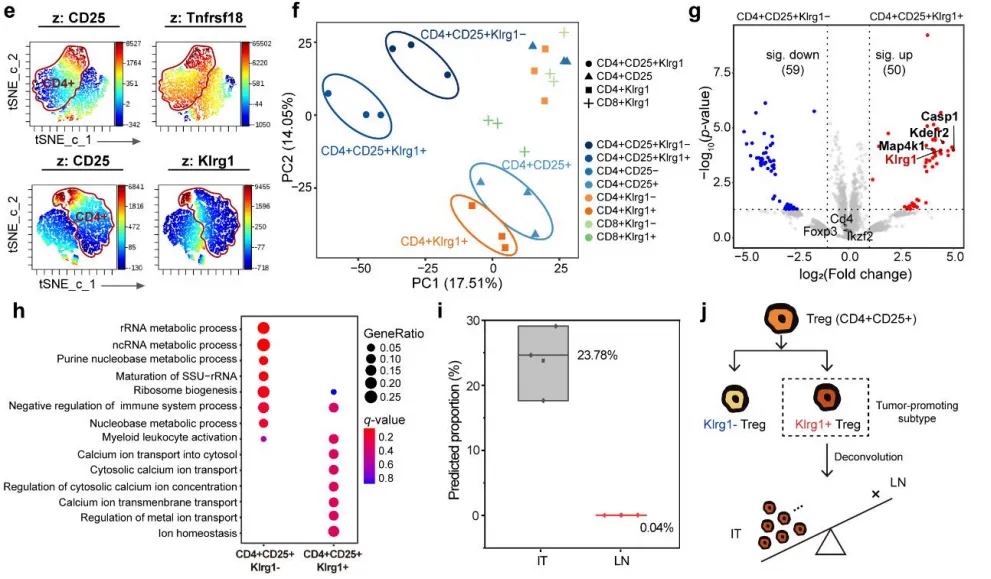
SCPro技术发现Klrg1+Treg亚群及其空间定位
五、总结
综上所述,作者开发了名为SCPro的空间可视化蛋白组学技术,并且通过将流式分选得到的细胞类型蛋白质组学数据反卷积到空间蛋白质组学数据中,发现新的细胞亚型并预测新细胞亚型的空间位置。这一方案扩展了传统数字组织病理学的全面性,为精细化研究组织微环境异质性和细胞亚群的空间分布提供了全新的分析方案参考。
深圳市贝普奥生物科技有限公司是一家于2022年1月在深圳成立的蛋白质组学研发型高科技公司。作为蛋白质组学上游市场解决方案提供商,公司致力于对蛋白质组学领域的研发成果进行商业开发及转化。团队以受多项专利保护的蛋白质组学前处理系列产品为切入点,通过临床功能蛋白质组学技术平台为目标市场提供全流程解决方案。
公司核心成员在蛋白质组学、肿瘤生物学领域获得重大科研成果,超半数员工拥有博士、硕士学位及海外研究经历。充满创造力的团队立足于大湾区,服务全球,专注于降低蛋白质组学分析技术难度,提升其在创新标志物和创新药物研发全链条中的应用,以蛋白质组学技术为重大疾病提供精准诊疗策略。
